Nomenclature
Rappel des conventions d'écriture
Remplacer les symboles des éléments métalliques (ou à prédominance métallique) par le symbole général M;
Remplacer les symboles des éléments non-métalliques (ou à prédominance non-métallique) par le symbole général X
Conserver les symboles de l'oxygène O et de l'hydrogène H;
Négliger les indices et les parenthèses.
De la sorte, nous obtenons les formules générales d'un nombre limité de corps purs composés:
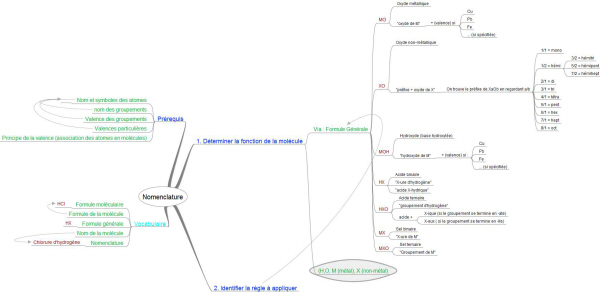
Formule générale Nom de la formule générale (nom de la fonction chimique) Exemple MO Oxyde métallique Fe2O3 XO Oxyde non-métallique CO2 MOH Hydroxyde (base hydroxylée) Ca(OH)2 HX Acide binaire (hydracide) HCl HXO Acide ternaire (oxacide) H3PO4 MX Sel binaire (sel d'hydracide) KCl MXO Sel ternaire (sel d'oxacide) Al2(SO4)3
soit 4 grandes fonctions (catégories):
|
Oxydes: MO et XO |
Hydroxydes ou bases hydroxylées: MOH |
Acides: HX et HXO |
Sels: MX et MXO |
![]() En
chimie, les molécules se lisent de droite à gauche ! Ainsi : Na2O
est de l'oxyde de sodium.
En
chimie, les molécules se lisent de droite à gauche ! Ainsi : Na2O
est de l'oxyde de sodium.
|
(*) Les points I.1. et I.2. sont adaptés du cours de M. J. Thonnard disponible sur http://www.proftnj.com/ch-nomen.htm |
I. Les Oxydes
I.1. nomenclature des Oxydes Métalliques
- Formule générale : MO (élément métallique et oxygène).
- Formation : M + O2. Ajout dioxygène à un élément métallique (réaction d'oxydation).
- Nomenclature : oxyde de M (M est à remplacer par le nom de l'élément métallique). (éventuellement : + valence entre parenthèses si nécessaire (I, II, III ou IV)).
Exemple : Na2O = oxyde de sodium | MgO = oxyde de magnésium, ...
I.2. nomenclature des oxydes non-métalliques
- Formule générale : XO (élément non-métallique et oxygène).
- Formation : X + O2 (réaction d'oxydation).
- Nomenclature : préfixe (O/X) oxyde de X
Comment trouver le préfixe ? Il faut faire le rapport entre le nombre d'atome d'oxygène et le nombre d'atome de l'élément non-métallique qui constituent la molécule à nommer. Il suffit ensuite de mettre le préfixe correspondant au rapport obtenu :
rapport (O/X) préfixe 1/2 hémi 1/1 mono 2/1 di 3/1 tri 4/1 tétra 5/1 pent 6/1 hexa 7/1 hept 5/2 hémipent 3/2 hémi tri (sesqui)
Les préfixes indiqués en bleu sont les plus couramment rencontrés. Ils sont aussi valables pour désigner des molécules composées des mêmes atomes (corps pures), exemple : H2 = Dihydrogène | O2 = Dioxygène, ...
Exemple : P2O5 = Hémi pentoxyde de phosphore
|
|
 |
II. Les Hydroxydes (bases hydroxylées)
II. nomenclature des hydroxydes ou bases hydroxylées
- Formule générale : MOH.
- Formation : MO + H2O (un oxyde métallique + de l'eau).
- Nomenclature : Hydroxyde de M (M étant le nom de l'élément métallique).
Exemple : LiOH : Hydroxyde de lithium | KOH : Hydroxyde de potassium
III. Les acides
III.1. nomenclature des acides binaires :
- Formule générale : HX
- Formation : X + H2 (réaction d'un élément non-métallique avec du dihydrogène).
- Nomenclature : X-ure d'hydrogène (nom de l'élément + terminaison en -ure d'hydrogène). Ancienne nomenclature : acide X-Hydrique (acide + nom de l'élément + terminaison en -hydrique).
Exemple : HBr = Bromure d'hydrogène | H2S = sulfure d'hydrogène
III.2. nomenclature des acides ternaires :
- Formule générale : HXO
- Formation : XO + H2O (réaction d'un oxyde non-métallique avec de l'eau)
- Nomenclature : Nom du groupement + d'hydrogène Ancienne nomenclature : Acide + nom du non-métal + terminaison -ique (+ riche en O) ou -eux (- riche en O)
Pour les groupements : -ate d'hydrogène (si + riche en O); -ite d'hydrogène (si - riche en O).
X-ite ou X-ate ?
-ate -ite nom
valence -CO3 / carbon- II -SO4 -SO3 sulf- II -NO3 -NO2 nitr- I -PO4 -PO3 phosph- III -ClO3 -ClO2 chlor- I Exemple : H2SO3 = sulfite d'hydrogène (ou acide sulfureux) | H2SO4: sulfate d'hydrogène (ou acide sulfurique).
|
|
 |
IV. Les sels
IV.1. nomenclature des sels binaires :
- Formule générale : MX + H2O (de l'eau est formée lors de la réaction formant un sel).
- Formation : MOH + HX (un hydroxyde + un acide binaire => un sel binaire + de l'eau) .
- Nomenclature : X-ure de M (valence)
Exemple : NaCl: chlorure de sodium | Fe2S3: sulfure de fer (III)
IV.2. nomenclature des sels ternaires :
- Formule générale : MXO + H2O (de l'eau est formée).
- Formation : MOH + HXO (un hydroxyde + un acide ternaire => sel ternaire + eau).
- Nomenclature : nom du groupement (-ite ou -ate) de M ( + valence si utile)
Exemple : K2SO3: sulfite de potassium | Fe2SO4: sulfate de fer (II)
| A retenir | Attention! |
| O à la valence
II
H à la valence I |
OH (hydroxyde) à la valence I NH4 (ammonium) à la valence I et est noté M CN (cyanure) à la valence I et est noté X |
IV.3. nomenclature des sels quaternaires :
- Formule générale : MHXO + H2O (de l'eau est formée).
- Formation : MOH + HXO mais avec un excès d'acide, donc de HXO. Si lors d'une réaction de neutralisation (acide + base) on utilise un excès d'acide, on forme un sel MHXO.
- Nomenclature :(di)hydrogéno nom de X + -ite ou -ate + nom de M
Exemples : sans excès d'acide H3PO4 + 3 NaOH --> Na3PO4 + 3H2O
HXO + MOH --> MXO + H2O
avec excès d'acide H3PO4 + 2NaOH --> Na2HPO4 + 2 H2O HXO + MOH ---> MHXO + H2O
nomenclature du composé Na2HPO4 : hydrogénophosphate de sodium nomenclature du composé NaH2PO4 : dihydrogénophosphate de sodium

V. Synthèse : formation/réactivité des fonctions chimiques principales et de leurs noms
| Formule générale | Nom de la formule générale (nom de la fonction chimique) | Formation / type de réactivité | Nomenclature | Exemple |
| XO | Oxyde non-métallique | X + O -> XO | préfixe(O/X) oxyde de X | P2O5 |
| MO | Oxyde métallique | M + O -> MO | Oxyde de M (valence) | Na2O |
| MOH | Hydroxyde (base hydroxylée) | MO + H2O ->MOH | Hydroxyde de M (valence) | LiOH |
| HX | Acide binaire (hydracide) | X + H2 -> XH | X-ure d'hydrogène acide x- hydrique |
H Br |
| HXO | Acide ternaire (oxacide) | XO + H2O -> HXO | <nom du
groupement> + d'hydrogène
Acide + nom du non-métal + terminaison -ique (+ riche en O) ou -eux (- riche en O) |
HNO2 HNO3 |
| MX | Sel binaire (sel d'hydracide) | MOH + HX -> MX + H2O | X-ure de M | PbCl2 |
| MXO | Sel ternaire (sel d'oxacide) |
MOH + HXO -> MXO + H2O |
<nom groupement> de M | Ba3( PO4 )2 |

Réservé à une utilisation strictement privée-tous droits de reproduction et de diffusion réservés - (c) L. Miseur - La chimie.net 2010
|
Copyright (c) 2000 - 2023 | Miseur Ludovic | www.lachimie.net | tous droits réservés | remis à jour le : 06/07/2023 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2023). Lachimie.net - Nomenclature. La Chimie.net. http://www.lachimie.net | |
|
|